miércoles, 21 de octubre de 2009
martes, 20 de octubre de 2009
Molecula del agua

Ahora siguiendo este modelo, realizaremos el modelo de la molecula de agua (H2O), primero tendremos que saber que elementos lo forman y tambien cuantos electrones tiene cada atomo, la molecula del agua esta formada por 2 atomos de hidrogeno, estos poseen un electron cada uno, y 1 atomo de oxigeno, este posee 8 electrones, pero Bohr decia que el atomo poseia varios orbitales, el mas cercano al nucleo poseia 2 electrones, de esta forma el oxigeno tendria 6 electrones en su ultima orbita.

en la imagen se muestran los 2 atomos de hidrogeno como se ve tienen un nucleo (bola color blanco) y el elctron ( bola color roja), en donde se puede ver que el nucleo es mas grande que el electron.

aqui se muestra la imagen de nuestro modelo del oxigeno, al centro se encuntra el nucleo con 8 protones (bola amarilla), recordemos que el numero atomico indica el numero de electrones que hay alrededor del nucleo y el numero de protones que hay en el nucleo, como se menciono anteriormente el oxigeno tiene 2 orbitas la primera con 2 electrones y la segunda con 6 y si als sumamos son 8 ( electrones bola azul).

En esta imagen ya se muestra el enlace que se forma al juntar los 2 atomos de hidrogeno junto con el de oxigeno, el hidrogeno comparte su unico electron con el oxigeno, y como son 2 hidrogenos se compartirian 2 electrones de hidrogeno con el oxigeno, de esta forma serian ya los 8 electrones en ultimo orbital del oxigeno.
Pot ultimo debemos tomar en cuenta que los electrones y protones de cada elemento son iguales, no se debe confundir con la teoria: del nivel en que se encuntre el elemento en la tabla periodica es el tamaño de los atomos ya que esta habla del atomo en general y no de sus particulas, tambien por que lo que se toma en cuenta es la cantidad y no el tamaño. asi un atomo de oxigeno es mas grande que un atomo de hidrogeno por que el oxigeno cuenta con 8 electrones y protones y el hidrogeno solo con 1 de ambos.
domingo, 18 de octubre de 2009
Videos de modelos atomicos, experimentos, cesar tapia barron
experimento de rutherford
modelo de Bohr
cuestionario JUAREZ SOTO SINUHE J.

las preguntas se encuentran ordenadas segun el equipo que las dictó.sin embargo no anote el no. de equipo:
¿QUIEN DESARROLLO EL PRIMER MODELO ATOMICO?
R= DALTON
¿CON QUE NOMBRE SE LE CONOCIA ANTES AL DALTONISMO?
R= A LAS PERSONAS SE LES LLAMABA DIACRONATICOS
¿MENSIONA LOS EXITOS DEL MODELO DE DALTON?
R= ºEXPLICABA QUE LAS SUSTANCIAS SE CONVINABAN QUIMICAMENTE ENTRE SI SOLO EN CIERTAS PROPORCIONES.
ºACLARABA QUE AUN EXISTIENDO UNA GRAN VARIEDAD DE SUSTANCIAS DIFERNTES ESTAS PODIAN SER EXPLICADASEN TERMINOS DE CANTIDAD MAS BIEN PEQUEÑA DE CONSTITUYENTES ELEMENTALES
ºEXPLICABA LA ÑAYOR PARTE DE LA QUIMICA ORGANICA
¿QUIEN INTRODUJO EL MODELO DE DALTON A LA QUIMICA?
R=INTRODUCE LA IDEA DE QUE EL ATOMO PUEDE DIVIDIRSE EN LAS LLAMADAS PARICULAS FUNDAMENTALES :º ELECTRONES, CON CARGA ELECTRICA NEGATIVA ºPROTONES CON CARGA POSITIVA ºNEUTRONES, SIN CARGA ELECTRICA Y CON UNA MASA MUCHO MAYOR QUE LA DE ELECTRONES Y PROTONES.
1. ¿Aproximadamente cuando nació Thompson y de donde era?
R=Nació el 18 de Diciembre de 1856 en el Reino Unido.
2. ¿En que consistió su modelo atómico?
R=Es un compuesto por electrones de carga negativa en un átomo positivo, como pasas en un budín. Se pensaba que los electrones se distribuían uniformemente alrededor del átomo.
3. ¿Qué hechos quería verificar con su hipótesis?
R=Que la masa atómica era neutra y divisible.
4. ¿Qué experimento realizo para comprobar la realización entre la carga y la masa de los electrones?
R= Pasar un haz de rayos catódicos por un campo eléctrico y uno de magnéticos.
5. ¿En que descubrimiento se baso para hacer su modelo y por cual fue superado?
R= Se baso en los electrones y fue superado por Rutherford.Rutherford.
1. ¿En que consistía el experimento de Rutherford?
R= que todo átomo estaba formado por núcleo y corteza, habiendo un espacio vacío entre ellos. También afirmaba que en el núcleo se encontraban reunidas todas las cargas positivas y casi toda la masa y que a su alrededor giran los electrones, describiendo órbitas circulares o elípticas.
2. ¿Dónde nació Rutherford?
R= Nueva Zelanda
3. ¿Menciona un postulado de Rutherford?
R= El átomo esta constituido por una zona central, a la que se le llama núcleo, en la que se encuentra concentrada toda la carga positiva y casi toda la masa del núcleo.
4. ¿A que modelo supero Rutherford?
R= Al de Thompson
5. Dibuja el modelo de Rutherford.
1. ¿Con quién trabajo y años después lo sucedió?
R= Con Bohr.
2. ¿De que otra manera fue llamado el experimento?
R= La lamina de oro.
3. ¿En que consistió el experimento?
R= En "bombardear" con un haz de partículas alfa una fina lámina de oro y observar cómo las láminas de diferentes metales afectaban a la trayectoria de dichos rayos
4. ¿Quién sucedió el modelo de Rutherford?
R= Bohr.
5. ¿Cuáles son las características del modelo? R= Las principales son-Un núcleo central, que contiene los protones y neutrones (y por tanto allí se concentra toda la carga positiva y casi toda la masa del átomo). · Una corteza, formada por los electrones, que giran alrededor del núcleo en órbitas circulares, de forma similar a como los planetas giran alrededor del Sol.Bohr.
1. ¿En que fecha nació Bohr y en donde?
R= 7 de Octubre de 1885 en Dinamarca.
2. ¿Escribe uno de los cuatro posgrados de Bohr?
R= Los electrones orbitan el átomo en niveles discretos y cuantizados de energía, es decir, no todas las órbitas están permitidas, tan sólo un número finito de éstas.
3. ¿En que año publico su modelo?
R= En 1911.
4. ¿En que elementos se baso el modelo de Bohr?
R=Se baso en sus tres postulados.
5. Dibuja su modelo.Bohr.
1. ¿En que elementos se baso Bohr para desarrollar su modelo, fue aprobado?
R= En sus postulados, dirigidos a los electrones.
2. ¿En que años fueron publicados los postulados de Borh?
R=En 19133.
¿Menciona al menos uno de los cuatro postulados de Bohr?
R= Los electrones orbitan el átomo en niveles discretos y cuantizados de energía, es decir, no todas las órbitas están permitidas, tan sólo un número finito de éstas.
4. ¿Realiza el diagrama de dicho modelo?
5. ¿Qué elementos de la física desarrollo para confirmar su modelo?
Con el electromagnetismo.
http://www.learner.org/courses/essential/physicalsci/images/s4.dalton.jpg
MODELO ATOMICO DE THOMPSON POR JUAREZ SOTO SINUHE J.
Una vez considerado el electrón como una partícula fundamental de la materia existente en todos los átomos, los físicos atómicos empezaron a especular sobre cómo estaban incorporadas estas partículas dentro de los átomos.
El modelo comúnmente aceptado era el que a principios del siglo XX propuso Joseph John Thomson, quién pensó que la carga positiva necesaria para contrarrestar la carga negativa de los electrones en un átomo neutro estaba en forma de nube difusa, de manera que el átomo consistía en una esfera de carga eléctrica positiva, en la cual estaban embebidos los electrones en número suficiente para neutralizar la carga positiva.
viernes, 16 de octubre de 2009
diferencia de modelo atomico por rene zermeño
ÁTOMO
ES LA PARTÍCULA MÁS PEQUEÑA DE LA MATERIA QUE NO SE PUEDE DIVIDIR
Pero a pesar de Esto…
Durante el paso del tiempo , se han tenido diferentes ideas del átomo
Las ideas más relevantes fueron…
Dalton
El átomo es una esfera sólida
ThompsonPudín con pasas: el átomo es positivo con incrustaciones negativas
Rutherford
Los electrones giran alrededor del núcleo
BohrLos electrones giran alrededor del núcleo en niveles de energía
— Respecto a los primeros modelos atómicos nos parece que fueron unos grandes descubrimientos ya que fue una gran labor por parte de los científicos estudiar y más tarde afirmar esos modelos, aunque luego otros científicos siguieran investigando y reestructurando esos modelos no se les quita ningún mérito ya que sirvieron como punto de partida para llegar al descubrimiento más acertado. No descartamos un próximo modelo atómico ya que la química está avanzando mucho y los científicos experimentan y descubren cada vez más cosas, aunque el modelo actual es el más concreto y acertado hasta el momento
experimento de rutherford por Juarez Soto SinuheJ.
Experimento realizado por Rutherford y G.Marsden. Bombardearon una lámina de oro con partículas alfa prodecentes de una fuente radiactiva, y colocaron una pantalla de Zns por detrás de la lámina de oro para así poder observar la dispersión de las partículas.
El experimento demostró que la dispersión de las partículas alfa con carga positiva era producida por la repulsión de centros negativos dentro de la placa de oro (también se cumple con el resto de los metales, no solo con el oro).
Dedujeron que cada átomo contenía un centro diminuto con carga positiva (núcleo atómico).
Los átomos, en su mayor parte, están constituídos por espacios vacíos, por eso la mayoría de las partículas alfa atraviesan la lámina sin desviarse. Las pocas partículas que se desvían son las que llegan a las cercanías de los núcleos.
ModeloAtomico de Dalton por Eluzay Hernandez
La observación de las cantidades fijas en las que diferentes sustancias químicas se combinaban para reaccionar químicamente, llevó a Dalton a la hipótesis de que existía una cantidad mínima o discreta de materia de cada sustancia que se combinaba de manera fija con un cierto número de unidades fijas de otras sustancias.
los postuladas de john dalton son:
- La materia está dividida en unas partículas indivisibles e inalterables, que se denominan átomos.
- Todos los átomos de un mismo elemento son idénticos entre sí (presentan igual masa e iguales propiedades).
- Los átomos de distintos elementos tienen distinta masa y distintas propiedades.
- Los compuestos se forman cuando los átomos se unen entre sí, en una relación constante y sencilla.
CUESTIONARIO ACERCA DE LA EXPOSICION DE JOHN DALTON
¿Que significa atomo?
Atomo significa en griego "no divisible"
¿Quien desarrollo el primer modelo atomico?
John Dalton
- Menciona los exitos de dalton
- El modelo atómico de Dalton explicaba porqué las sustancias se combinaban químicamente entre sí sólo en ciertas proporciones.
- Además el modelo aclaraba que aún existiendo una gran variedad de sustancias diferentes, estas podían ser explicadas en términos de una cantidad más bien pequeña de constituyentes elementales o elementos.
- En esencia, el modelo explicaba la mayor parte de la química orgánica del siglo XIX, reduciendo una serie de hechos complejos a una teoría combinatoria realmente simple.
Introduce la idea de que el atomo puede dividirse en las particuls fundamentales.
POSTULADOS DE NIELS BOHR
En 1913, Niels Bohr desarrolló su célebre modelo atómico de acuerdo a cuatro postulados fundamentales:
- Los electrones orbitan el átomo en niveles discretos y cuantizados de energía, es decir, no todas las órbitas están permitidas, tan sólo un número finito de éstas.
- Los electrones pueden saltar de un nivel electrónico a otro sin pasar por estados intermedios.
- El salto de un electrón de un nivel cuántico a otro implica la emisión o absorción de un único cuanto de luz (fotón) cuya energía corresponde a la diferencia de energía entre ambas órbitas.
- Las órbitas permitidas tienen valores discretos o cuantizados del momento angular orbital L de acuerdo con la siguiente ecuación:

- Donde n = 1,2,3,… es el número cuántico angular o número cuántico principal.
La cuarta hipótesis asume que el valor mínimo de n es 1. Este valor corresponde a un mínimo radio de la órbita del electrón de 0.0529 nm. A esta distancia se le denomina radio de Bohr. Un electrón en este nivel fundamental no puede descender a niveles inferiores emitiendo energía.
Se puede demostrar que este conjunto de hipótesis corresponde a la hipótesis de que los electrones estables orbitando un átomo están descritos por funciones de onda estacionarias. Un modelo atómico es una representación que describe las partes que tiene un átomo y como están dispuestas para formar un todo.
Basándose en la constante de Planck  consiguió cuantizar las órbitas observando las líneas del espectro.
consiguió cuantizar las órbitas observando las líneas del espectro.
ESPECTRO
El Espectro Electromagnético es un conjunto de ondas que van desde las ondas con mayor longitud como "Las ondas de radio" hasta los que tienen menor longitud como los "Los rayos Gamma".
Es importante anotar que las ondas con mayor longitud de onda tienen menor frecuencia y viceversa.
Las características propias de cada tipo de onda no solo es su longitud de onda, sino también su frecuencia y energía.
El espectro electromagnético se divide en:- RADIO
- MICROONDAS
- INFRARROJO
- LUZ VISIBLE
- ULTRAVIOLETA
- RAYOS X
- RAYOS GAMMA
atomo de dalton
Modelo atómico de Dalton
En 1808 Dalton formuló su teoría atómica, teoría que rompía con todas las ideas tradicionales (Demócrito, Leucipo).
Introduce la idea de la discontinuidad de la materia, es decir, es la primera teoría científica que considera que la materia está dividida en átomos. Los postulados básicos de esta teoría son:
-La materia está dividida en unas partículas indivisibles e inalterables llamadas átomos.
-Los átomos son partículas muy pequeñas y no se pueden ver a simple vista.
-Todos los átomos de un mismo elemento son iguales entre sí, igual masa e iguales propiedades.
-Los átomos de distintos elementos tienen distinta masa y distintas propiedades.
-Los compuestos se forman cuando los átomos se unen entre sí, en una relación constante y sencilla.
-En las reacciones químicas los átomos se separan o se unen; pero ningún átomo se crea ni se destruye, y ningún átomo de un elemento se convierte en átomo de otro elemento.
Esta concepción se mantuvo casi durante un siglo.
Modelos atomicos por Cesar Tapia Barron

Antes que nada para hablar de modelos atomicos necesitamos hablar de atomo, pero ¿ que es un atomo?, bueno un atomo es la unidad más pequeña de un elemento qumico que mantiene su identidad o sus propiedades y que no es posible dividir mediante procesos quimicos.
Ahora que sabemos un poco sobre los atomos podemos hablar sobre los modelos atomicos, el primer modelo atomico que se dio a conocer fue el modelo del cientifico John Dalton, el cual representaba al atomo con una esfera.Este primer modelo atómico postulaba:
- La materia está formada por partículas muy pequeñas llamadas átomos, que son indivisibles y no se pueden destruir.
- Los átomos de un mismo elemento son iguales entre sí, tienen su propio peso y cualidades propias. Los átomos de los diferentes elementos tienen pesos diferentes.
- Los átomos permanecen sin división, aún cuando se combinen en las reacciones químicas.
- Los átomos, al combinarse para formar compuestos guardan relaciones simples.
- Los átomos de elementos diferentes se pueden combinar en proporciones distintas y formar más de un compuesto.
- Los compuestos químicos se forman al unirse átomos de dos o más elementos distintos.
El modelo que siguio al de Dalton fue el de Thomson.
Thomson suponía que los electrones se distribuía de una forma uniforme alrededor del átomo, conocido este modelo como Pastel de pasas, es la teoría de estructura atómica, Thomson descubre el electrón antes que se descubriera el protón y el neutrón.
el átomo se compone por electrones de carga negativa en el átomo positivo.
Pensaba que los electrones, distribuidos uniformemente alrededor del átomo, en distintas ocasiones, en vez de una sopa de las cargas positivas, se postulaba con una nube de carga positiva.
Sus postulados eran:
a) Que la materia es eléctricamente neutra, esto permitiría pensar que aparte de electrones, es posible que halla partículas con cargas positivas.
b). Es posible extraer electrones de los átomos, pero no del mismo modo las cargas positivas.
Primer experimento de Thomson.
Thomson investigó si podrían ser separadas las cargas negativas de los rayos catódicos y utiliza un medio el del magnetismo.
Para este experimento construyo un tubo de rayos catódicos el cual al final del tubo termina en dos cilindros con ranuras, las ranuras fueron conectadas a su vez a un electrómetro.
Con este método Thomson descubre que cuando los rayos son desviados magnéticamente de tal forma que no puedan entrar en las hendiduras, el electrómetro marca al registrar poca carga.
Esto llevo a Thomson a la conclusión que la carga negativa es inseparable de los rayos.
Segundo Experimento de Thomson
Para este segundo experimento, JJ Thomson construye un tubo de rayos catódicos, logrando un vacío casi perfecto, en uno de sus extremos lo recubre con pintura fosforescente.
La intención del este experimento era investigar si estos rayos podían ser desviados con un campo eléctrico, se conocía que en anteriores experimentos no se habían observado este fenómeno (esto es muy característico de las partículas con carga).
Con la creación de este tubo en el que en uno de sus extremos estaba recubierto con pintura fosforescente, Thomson descubre que muchos rayos si se podían doblar con la influencia de un campo magnetizado.
Tercer experimento
Para el tercer experimento, Thomson fundamento la relación que hay entre la masa de los rayos catódicos y la carga, para esto mide la cantidad que se desvía por un campo magnético y cuanta cantidad de carga de energía contenida.
La relación masa/carga que encuentra es de un millar de veces superior a la que contiene el ión de Hidrógeno, esto indica que bien las partículas deben ser más livianas o con mucha más carga.
Aquí Thomson toma una posición audaz: Thomson, a los rayos catódicos que estaban cargados por partículas les llamó “corpúsculos” dichos corpúsculos se originaban dentro de los atomos de los electrodos, a lo que esto significaba, que los átomos deben ser divisibles, imagina “un mar” totalmente repleto de cargas positivas en estos corpúsculos en el átomo, es por esto que se le llama y conoce con el nombre de budín de pasas al modelo de Thomson.
El premio novel de física lo obtiene en 1906, gracias al trabajo que realizo sobre la conducción de la electricidad a través de los gases.
La forma de su explicación de que el átomo esta formado por un núcleo unido y compacto y que en su exterior la denomina como corteza, deja mucha puertas abiertas tanto para Ernest Rutherford o Niels Bohr, quienes continúan con esta investigación dando luz y planteando otras teorías para los atomos y las partes diferenciadas
El que le sucedio fuel el modelo de Rutherford, todo átomo estaba formado por núcleo y corteza, habiendo un espacio vacío entre ellos. También afirmaba que en el nucleo se encontraban reunidas todas las cargas positivas y casi toda la masa y que a su alrededor giran los electrones, describiendo órbitas circulares o elipticas.
Según Rutherford, las órbitas de los electrones no estaban muy bien definidas y forman una estructura compleja alrededor del núcleo, dándole un tamaño y forma indefinida. También calculó que el radio de átomo, según su modelo, era diez veces mayor que el núcleo mismo, lo que hace que haya un gran espacio vacio en el átomo.
La falla del modelo de Rutherford radica en el planteamiento de que toda partícula eléctrica, separada de su posición de equilibrio, vibra con una frecuencia determinada, originando la emisión de una onda electromagnética. Esta vibración disminuye cuando pierde energía, hasta quedar en reposo, por lo que la fuerza centrífuga se anula, ocasionando un choque entre el electrón y el núcleo.
el ralizo un experimento para justificar su modelo , el cual era el siguiente:
consistió en "bombardear" con un haz de particulas alfa una fina lámina de oro y observar cómo las láminas de diferentes metales afectaban a la trayectoria de dichos rayos.
Las partículas alfa se obtenían de la desintegración de una sustancia radiactiva, el polonio. Para obtener un fino haz se colocó el polonio en una caja de plomo, el plomo detiene todas las partículas, menos las que salen por un pequeño orificio practicado en la caja. Perpendicular a la trayectoria del haz se interponía la lámina de metal. Y, para la detección de trayectoria de las partículas, se empleó una pantalla con sulfuro de zinc que produce pequeños destellos cada vez que una partícula alfa choca con él.
Según el modelo de Thomson, las partículas alfa atravesarían la lámina metálica sin desviarse demasiado de su trayectoria:
- La carga positiva y los electrones del átomo se encontraban dispersos de forma homogénea en todo el volumen del átomo. Como las partículas alfa poseen una gran masa (8.000 veces mayor que la del electrón) y gran velocidad (unos 20.000 km/s), la fuerzas eléctricas serían muy débiles e insuficientes para conseguir desviar las partículas alfa.
- Además, para atravesar la lámina del metal, estas partículas se encontrarían con muchos átomos, que irían compensando las desviaciones hacia diferentes direcciones.
Pero se observó que un pequeño porcentaje de partículas se desviaban hacia la fuente de polonio, aproximadamente una de cada 8.000 partícula al utilizar una finísima lámina de oro con unos 200 átomos de espesor. En palabras de Rutherford ese resultado era "tan sorprendente como si le disparases balas de cañón a una hoja de papel y rebotasen hacia ti".
Rutherford concluyó que el hecho de que la mayoría de las partículas atravesaran la hoja metálica, indica que gran parte del átomo está vacío, que la desviación de las partículas alfa indica que el deflector y las partículas poseen carga positiva, pues la desviación siempre es dispersa. Y el rebote de las partículas alfa indica un encuentro directo con una zona fuertemente positiva del átomo y a la vez muy densa.
Rutherford propuso los siguientes postulados:
1. El átomo esta constituido por una zona central, a la que se le llama núcleo, en la que se encuentra concentrada toda la carga positiva y casi toda la masa del núcleo.
2. Hay otra zona exterior del átomo, la corteza, en la que se encuentra toda la carga negativa y cuya masa es muy pequeña en comparación con la del átomo. La corteza esta formada por los electrones que tenga el átomo.
3. Los electrones se están moviendo a gran velocidad en torno al núcleo.
4. El tamaño del núcleo es muy pequeño en comparación con el del átomo (unas 100.000 veces menor).
5. El número de electrones negativos es igual al numero de protones positivos; luego, el átomo resulta neutro
El modelo que le sigio fue el del fisico danes Niels Bohr, espués de haber visitado el laboratorio de Rutherford en Manchester, y teniendo en cuenta los conocimientos que tenía acerca de los espectros atómicos provenientes de los físicos suecos Rydberg y Ångstrom, así como del suizo Balmer. Bohr pudo deducir la formula de Balmer, que da las longitudes de onda de la luz emitida por el átomo de hidrógeno, las cuales fueron medidas con suficiente precisión por Rydberg y Ångstrom.
El modelo de Bohr supone que cuando un electrón se encuentra en una órbita determinada que cumple con la condición de que el momentum angular es múltiplo entero de la constante de Planck dividida por dos pi, no hay emisión de radiación electromagnética. Esto evidentemente contradice la teoría electromagnética de Maxwell, pero, da una luz acerca de los misteriosos espectros atómicos, los cuales se generan, cuando el electrón atómico hace una transición de una órbita de radio mayor a una órbita de radio menor. Esto ultimo también es incomprensible pues es de esperarse, que la frecuencia de la radiación emitida coincida con alguna frecuencia de oscilación de los electrones.
Es muy interesante, que el modelo de Bohr da resultados coincidentes con los de la física clásica en el caso, en el que las transiciones ocurren entre niveles de energía muy grandes. Esto indicaría que en efecto para fenómenos macroscópicos sería valida la física clásica, mientras que para fenómenos microscópicos -de escala atómica- ya no se cumple la física clásica, sino la nueva física cuántica, que empezó desarrollarse en el año de 1900 con los trabajos de Planck, y que recibió un impulso grande en 1905 con el trabajo de Einstein sobre el efecto fotoeléctrico.
El átomo de Bohr represento un impulso decisivo para el desarrollo de la teoría cuántica, aun cuando sus postulados acerca de la no radiación en órbitas estacionarias, y de radiación solo en el cambio entre estas órbitas, resultase, muy difícil, o mejor imposible en aquella época, de comprender intuitivamente.
Postulados de Bohr
- Los electrones orbitan el átomo en niveles discretos y cuantizados de energía, es decir, no todas las órbitas están permitidas, tan sólo un número finito de éstas.
- Los electrones pueden saltar de un nivel electrónico a otro sin pasar por estados intermedios.
- El salto de un electrón de un nivel cuántico a otro implica la emisión o absorción de un único cuanto de luz (foton) cuya energía corresponde a la diferencia de energía entre ambas órbitas.
- Las órbitas permitidas tienen valores discretos o cuantizados del momento angular orbital L de acuerdo con la siguiente ecuación:

- Donde n = 1,2,3,… es el numero cuantico angular o número cuántico principal.
La cuarta hipótesis asume que el valor mínimo de n es 1. Este valor corresponde a un mínimo radio de la órbita del electrón de 0.0529 nm. A esta distancia se le denomina radio de Bohr. Un electrón en este nivel fundamental no puede descender a niveles inferiores emitiendo energía.

1.-¿ Que significa atomo?
R=es la unidad más pequeña de un elemento quimico que mantiene su identidad o sus propiedades y que no es posible dividir mediante procesos quimicos.
2.-¿Quien desarrollo el primer modelo atomico?
R= Fue John Dalton
3.-¿Con que nombre se le conocia antes al daltonismo?
R=
4.-Menciona los exitos del modelo de Dalton:
- El modelo atómico de Dalton explicaba porqué las sustancias se combinaban químicamente entre sí sólo en ciertas proporciones.
- Además el modelo aclaraba que aún existiendo una gran variedad de sustancias diferentes, estas podían ser explicadas en términos de una cantidad más bien pequeña de constituyentes elementales o elementos.
- En esencia, el modelo explicaba la mayor parte de la química orgánica del sigloXIX, reduciendo una serie de hechos complejos a una teoría combinatoria realmente simple.
R= La aparicion del atomo
6.-¿Aproximadamente en que año vivio Thomson y de donde era?
R= Vivio en 1856 y era del reino unido
7.-¿En que consistio su modelo atomico?
R=el atono está compuesto por electrones de carga negativa en un átomo positivo, como pasas en un budín. Se pensaba que los electrones se distribuían uniformemente alrededor del átomo.
8.-¿Cuales eran los 2 hechos que queria justificar con sus hipotesis?
R=1 que el atomo debia contar con una carga positiva
2 que el atomo era neutro
9.-¿Que experimento realizo para comprobar la relacion entre las carga y la masa de las particulas?
R=Thomson fundamento la relación que hay entre la masa de los rayos catódicos y la carga, para esto mide la cantidad que se desvía por un campo magnético y cuanta cantidad de carga de energía contenida.
La relación masa/carga que encuentra es de un millar de veces superior a la que contiene el ión de Hidrógeno, esto indica que bien las partículas deben ser más livianas o con mucha más carga.
Aquí Thomson toma una posición audaz: Thomson, a los rayos catódicos que estaban cargados por partículas les llamó “corpúsculos” dichos corpúsculos se originaban dentro de los atomos de los electrodos, a lo que esto significaba, que los átomos deben ser divisibles, imagina “un mar” totalmente repleto de cargas positivas en estos corpúsculos en el átomo, es por esto que se le llama y conoce con el nombre de budín de pasas al modelo de Thomson.
10.-¿En que se baso para hacer su modelo y por cual fue superado?R=Se baso en el modelo de Dalton y fue superado por el de Rutherford
11.-¿En que consistia el modelo de Rutherford?
R=consistió en "bombardear" con un haz de particulas alfa una fina lámina de oro y observar cómo las láminas de diferentes metales afectaban a la trayectoria de dichos rayos.
Las partículas alfa se obtenían de la desintegración de una su
stancia radiactiva, el polonio. Para obtener un fino haz se colocó el polonio en una caja de plomo, el plomo detiene todas las partículas, menos las que salen por un pequeño orificio practicado en la caja. Perpendicular a la trayectoria del haz se interponía la lámina de metal. Y, para la detección de trayectoria de las partículas, se empleó una pantalla con sulfuro de zinc que produce pequeños destellos cada vez que una partícula alfa choca con él.
Según el modelo de Thomson, las partículas alfa atravesarían la lámina metálica sin desviarse demasiado de su trayectoria:
- La carga positiva y los electrones del átomo se encontraban dispersos de forma homogénea en todo el volumen del átomo. Como las partículas alfa poseen una gran masa (8.000 veces mayor que la del electrón) y gran velocidad (unos 20.000 km/s), la fuerzas eléctricas serían muy débiles e insuficientes para conseguir desviar las partículas alfa.
- Además, para atravesar la lámina del metal, estas partículas se encontrarían con muchos átomos, que irían compensando las desviaciones hacia diferentes direcciones.
Pero se observó que un pequeño porcentaje de partículas se desviaban hacia la fuente de polonio, aproximadamente una de cada 8.000 partícula al utilizar una finísima lámina de oro con unos 200 átomos de espesor. En palabras de Rutherford ese resultado era "tan sorprendente como si le disparases balas de cañón a una hoja de papel y rebotasen hacia ti".
Rutherford concluyó que el hecho de que la mayoría de las partículas atravesaran la hoja metálica, indica que gran parte del átomo está vacío, que la desviación de las partículas alfa indica que el deflector y las partículas poseen carga positiva, pues la desviación siempre es dispersa. Y el rebote de las partículas alfa indica un encuentro directo con una zona fuertemente positiva del átomo y a la vez muy densa.
12.-¿Donde nacio Rutherford?
R=En Nueva Zelanda el 30 de agosto de 1878
13.-¿A que modelo supero Rutherford?
R=Al de Thomson
14.- Menciona un postulado de Rutherford:
R=El número de electrones negativos es igual al numero de protones positivos; luego, el átomo resulta neutro
16.-¿Con quien trabajo Rutherford y años despues lo sucedio?
R= Con Niels Bohr
17.-¿De que otra manera fue llamado el experimento de Rutherford?
R= Experimento de lamina de oro
18.-¿En que consistio el experimento de Rutherford?
R=consistió en "bombardear" con un haz de particulas alfa una fina lámina de oro y observar cómo las láminas de diferentes metales afectaban a la trayectoria de dichos rayos.
Las partículas alfa se obtenían de la desintegración de una su
stancia radiactiva, el polonio. Para obtener un fino haz se colocó el polonio en una caja de plomo, el plomo detiene todas las partículas, menos las que salen por un pequeño orificio practicado en la caja. Perpendicular a la trayectoria del haz se interponía la lámina de metal. Y, para la detección de trayectoria de las partículas, se empleó una pantalla con sulfuro de zinc que produce pequeños destellos cada vez que una partícula alfa choca con él.
Según el modelo de Thomson, las partículas alfa atravesarían la lámina metálica sin desviarse demasiado de su trayectoria:
* La carga positiva y los electrones del átomo se encontraban dispersos de forma homogénea en todo el volumen del átomo. Como las partículas alfa poseen una gran masa (8.000 veces mayor que la del electrón) y gran velocidad (unos 20.000 km/s), la fuerzas eléctricas serían muy débiles e insuficientes para conseguir desviar las partículas alfa.
* Además, para atravesar la lámina del metal, estas partículas se encontrarían con muchos átomos, que irían compensando las desviaciones hacia diferentes direcciones.
Pero se observó que un pequeño porcentaje de partículas se desviaban hacia la fuente de polonio, aproximadamente una de cada 8.000 partícula al utilizar una finísima lámina de oro con unos 200 átomos de espesor. En palabras de Rutherford ese resultado era "tan sorprendente como si le disparases balas de cañón a una hoja de papel y rebotasen hacia ti".
Rutherford concluyó que el hecho de que la mayoría de las partículas atravesaran la hoja metálica, indica que gran parte del átomo está vacío, que la desviación de las partículas alfa indica que el deflector y las partículas poseen carga positiva, pues la desviación siempre es dispersa. Y el rebote de las partículas alfa indica un encuentro directo con una zona fuertemente positiva del átomo y a la vez muy densa.
19.-¿Cuales son las principales caracteristica del modelo de Rutherford?
R=· Un núcleo central, que contiene los protones y neutrones (y por tanto allí se concentra toda la carga positiva y casi toda la masa del átomo).
· Una corteza, formada por los electrones, que giran alrededor del núcleo en órbitas circulares, de forma similar a como los planetas giran alrededor del Sol.
20.-¿Quien fue el que le sucedio al modelo de Rutherford?
R= El modelo de Bohr
21.-¿En que lugar y fecha nacio Bohr?
R=Nacio el 7 de octubre de 1885 en Copenhague Dinamarca
22.-Escribe uno de los 4 postulados:
R=El electrón gira alrededor del núcleo en órbitas circulares sin emitir energía radiante.
23.-¿En que año publico su modelo?
R=En 1913
24.-Dibuja el modelo de Bohr:

25.-En que elementos se baso el modelo de Bohr:
R=partía conceptualmente del modelo de Rutherford y de las incipientes ideas sobre cuantización que habían surgido unos años antes con las investigaciones de Max Planck y Albert Einstein.
26.-¿En que elementos se baso Bohr para desarrolar su modelo y por que no fue aprobado?
R= partía conceptualmente del modelo de Rutherford y de las incipientes ideas sobre cuantización que habían surgido unos años antes con las investigaciones de Max Planck y Albert Einstein, y no fue aprobado por que el modelo de Bohr permitió explicar adecuadamente el espectro del átomo de hidrógeno, pero fallaba al intentar aplicarlo a átomos polielectrónicos y al intentar justificar el enlace químico.
· Además, los postulados de Bohr suponían una mezcla un tanto confusa de mecánica clásica y mecánica cuántica.
· El modelo no consigue explicar como los átomos individuales obran recíprocamente con otros átomos para formar los agregados de la sustancia que observamos
27.-¿En que años fueron publicados los postulados de Bohr?
R=En 1913
28.-Menciona almenos 1 de los 4 postulados de dicho cientifico:
R=La energía liberada al caer el electrón desde una órbita a otra de menor energía se emite en forma de fotón, cuya frecuencia viene dada por la ecuación de Planck:
Ea - Eb = h
29.-Realiza un diagrama de dicho modelo:

30.-¿Que elementos de la fisica desarrollo para confirmar su modelo?
R=afirmó que los movimientos internos que tienen lugar en el átomo están regidos por leyes particulares, ajenas a las de la Física tradicional. también que los electrones, cuando se hallan en ciertos estados estacionarios, dejan de irradiar energía.
jueves, 8 de octubre de 2009
postulados de bohr por Juarez Soto Sinuhe
El electrón gira alrededor del núcleo en órbitas circulares sin emitir energía radiante.
Segundo postulado :
Así, el Segundo Postulado nos indica que el electrón no puede estar a cualquier distancia del núcleo, sino que sólo hay unas pocas órbitas posibles, las cuales vienen definidas por los valores permitidos para un parámetro que se denomina número cuántico, n.
tercer postulado
Así, cuando el átomo absorbe (o emite) una radiación, el electrón pasa a una órbita de mayor (o menor) energía, y la diferencia entre ambas órbitas se corresponderá con una línea del espectro de absorción (o de emisión).
Correcciones al modelo de Bohr: números cuánticos.
En el modelo original de Bohr, se precisa un único parámetro (el número cuántico principal, n), que se relaciona con el radio de la órbita circular que el electrón realiza alrededor del núcleo, y también con la energía total del electrón. Los valores que puede tomar este número cuántico son los enteros positivos: 1, 2, 3...
Sin embargo, pronto fue necesario modificar el modelo para adaptarlo a los nuevos datos experimentales, con lo que se introdujeron otros tres números cuánticos para caracterizar al electrón:
· Número cuántico secundario o azimutal (l)
· Número cuántico magnético (m)
· Número cuántico de espín (s)
Número cuántico secundario o azimutal (l): corrección de Sommerfeld.
En 1916, Sommerfeld modificó el modelo de Bohr considerando que las órbitas del electrón no eran necesariamente circulares, sino que también eran posibles órbitas elípticas; esta modificación exige disponer de dos parámetros para caracterizar al electrón.
Una elipse viene definida por dos parámetros, que son los valores de sus semiejes mayor y menor. En el caso de que ambos semiejes sean iguales, la elipse se convierte en una circunferencia.
Así, introducimos el número cuántico secundario o azimutal (l), cuyos valores permitidos son:
l = 0, 1, 2, ..., n - 1
Por ejemplo, si n = 3, los valores que puede tomar l serán: 0, 1, 2
Número cuántico magnético (m).
Indica las posibles orientaciones en el espacio que puede adoptar la órbita del electrón cuando éste es sometido a un campo magnético externo (efecto Zeemann).
Valores permitidos: - l, ..., 0, ..., + l
Por ejemplo, si el número cuántico secundario vale l = 2, los valores permitidos para m serán: -2, -1, 0, 1, 2
El efecto Zeemann se debe a que cualquier carga eléctrica en movimiento crea un campo magnético; por lo tanto, también el electrón lo crea, así que deberá sufrir la influencia de cualquier campo magnético externo que se le aplique.
Número cuántico de espín (s).
Indica el sentido de giro del electrón en torno a su propio eje. Puede tomar sólo dos valores: +1/2, -1/2.
Insuficiencias del modelo de Bohr.
· El modelo de Bohr permitió explicar adecuadamente el espectro del átomo de hidrógeno, pero fallaba al intentar aplicarlo a átomos polielectrónicos y al intentar justificar el enlace químico.
· Además, los postulados de Bohr suponían una mezcla un tanto confusa de mecánica clásica y mecánica cuántica.
· El modelo no consigue explicar como los átomos individuales obran recíprocamente con otros átomos para formar los agregados de la sustancia que observamos.
martes, 6 de octubre de 2009
los atomos de bohr
Modelo atómico de Bohr por Juarez Soto Sinuhe J.
El modelo de Bohr es muy simple y recuerda al modelo planetario de Copérnico, los planetas describiendo órbitas circulares alrededor del Sol. El electrón de un átomo o ión hidrogenoide describe también órbitas circulares, pero los radios de estas órbitas no pueden tener cualquier valor.
Consideremos un átomo o ión con un solo electrón. El núcleo de carga Ze es suficientemente pesado para considerarlo inmóvil,
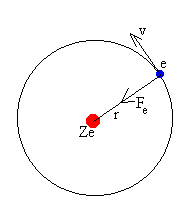 | Si el electrón describe una órbita circular de radio r, por la dinámica del movimiento circular uniforme
|
En el modelo de Bohr, solamente están permitidas aquellas órbitas cuyo momento angular está cuantizado.
![]()
n es un número entero que se denomina número cuántico, y h es la constante de Planck 6.6256·10-34 Js
Los radios de las órbitas permitidas son
![]()
donde a0 se denomina radio de Bohr. a0 es el radio de la órbita del electrón del átomo de Hidrógeno Z=1 en su estado fundamental n=1.
La energía total es
![]()
En una órbita circular, la energía total E es la mitad de la energía potencial
![]()
La energía del electrón aumenta con el número cuántico n.
La primera energía de excitación es la que lleva a un átomo de su estado fundamental a su primer (o más bajo) estado excitado. La energía del estado fundamental se obtiene con n=1, E1= -13.6 eV y la del primer estado excitado con n=2, E2=-3.4 eV. Las energías se suelen expresar en electrón-voltios (1eV=1.6 10-19 J)
La frecuencia f de la radiación emitida cuando el electrón pasa del estado excitado E2 al fundamental E1 es
![]()
Seguidores
Datos personales
Archivo del blog
-
▼
2009
(14)
-
▼
octubre
(14)
- este es un video sobre la distribucion de una mole...
- video de la molecula del agua
- Molecula del agua
- Videos de modelos atomicos, experimentos, cesar ta...
- cuestionario JUAREZ SOTO SINUHE J.
- MODELO ATOMICO DE THOMPSON POR JUAREZ SOTO SINUHE J.
- video sobre modelos atomicos por juarez soto sinuhe
- diferencia de modelo atomico por rene zermeño
- experimento de rutherford por Juarez Soto SinuheJ.
- ModeloAtomico de Dalton por Eluzay Hernandez
- atomo de dalton
- Modelos atomicos por Cesar Tapia Barron
- postulados de bohr por Juarez Soto Sinuhe
- los atomos de bohr
-
▼
octubre
(14)


